BAB 4 MATERI / BENDA/ ZAT

butiran garam
A. LARUTAN ASAM
Dalam keiidupan sehari-hari kita sering merasakan atau mengkonsumsi makanan atau buahbuahan yang rasanya masam. Contohnya asam cuka kita sering menggunakannya untukcampuran
makan bakso dan acar atau makanan Sumatera empek-empek.
Sari jeruk dan vitamin C sangat dibutuhkan oleh sel-sel tubuh kita. sari jeruk tidak lain adalah asam
sitrat dan vitamin C adalah asam askorbat, dalam lambung terdapat asam lambung yang sesungguhnya asam clorida. Asam ada!ah zat yang bila dilarutkan dalam air dapat menghasilkan ion H+.
Pemahaman sifat asam secara sederhana:
• Rasanya masam (awas : tidak semua asam boleh dirasakan)
• Dengan logam bereaksi / sifat korosif asam.
• Mengubah warna Iakmus biru menjadi merah.
• Dengan indicator phenolphthaLein (pp ) warnanya tetap.
• Bereaksi dengan basa membentuk garam.
• Namanya diawali dengan nama asam.
• Rumus senyawanya umumnya diawali dengan lambang atom H.
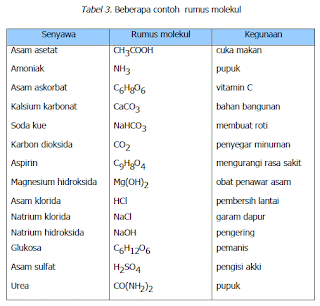
CONTOH-CONTOH ASAM DAN RUMUSNYA
• Asam cuka / asam asetat : CH3000H : campuran makan bakso.
• Asam Clorida : HCI dalam asam lambung.
• Asam sulfat : H2S04: digunakan pada accu.
• Asam sulida H2S pada telur busuk.
• Asam formiat: HCOOH pada semut disebut asam semut.
• Asam nitrat : HNQ3 membuat air raja ( campuran asam clorida dan asam nitrat ) untuk melarutkan emas.
• Asam carbonat: H2C03
• Asam bromida : HBr
• Asam clorat : HCIO3
B. LARUTAN BASA
Contoh nyata dalam kehidupan sehari-hari penggunaan basa adalah penggunaan sabun, baik sabun mandi atau sabun cuci. Atau penggunaan soda api atau kostik soda yang memberikan dampak pada kulit terasa panas atau merusakkan kulit. Basa adalah zat yang bila dilarutkan dalam air
menghasilkan ion OH-.
Pemahaman Sifat basa secara sederhana:
• Rasanya pahit ( analogi dari sabun. selain sabun jangan coba merasakan basa)
• Mengubah warna lakmus merah menjadi biru.
• Dengan indicator phenolphthalein (pp ) warnanya menjadi merah.
• Bereaksi dengan asam menghasilkan garam
• Namanya diakhiri dengan hidroksida.
• Rumus senyawanya diakhiri dengan lambang OH (umumnya).
CONTOH-CONTOH BASA DAN RUMUSNYA• Natriurn hidroksida / soda api: NaOH: untuk membuat sabun.
• Amonia / ammonium hidroksida: NH3 (aq ) / NH4OH: pelarut desinfektan,
• Alumunium hidroksida : Al(OH)3: membuat obat nyeri lambung.
• Kalium hidroksida : pembuatan sabun
• Calsium hidroksida
• Magnesium hidroksida
• Barium hidroksida
C. GARAM
Pemahaman garam secara sederhana kita awali dari nama garam secara umum yaitu garam dapur yang secara kimia namanya Natrium Clorida / NaCI. Yang dapat dibuat jika kita memanaskan air taut. Dalam laboratorium garam NaCI dapat kita buat dengan mereaksikan antara larutan asam Clorida dan larutan Natriurn Hidroksida, dengan volume dan konsentrasi larutan yang sama. Kalau kita perhatikan rumusnya NaCI merupakan gabungan dari : rumus depan suatu basa ( Na ) dan rumus akhir suatu asam ( CI).
D. MACAM GARAM
Berdasarkan rumus dan sifatnya garam dapat digolongkan menjadi 5 macam garam yaitu:
a. Garam Normal
b. Garam asam
c. Garam basa
d. Garam rangkap
e. Garam komplek
GARAM NORMAL
Yaitu golongan garam yang tersusun dan ion positip logam (termasuk NH4) dengan ion sisa asam.
Contohnya: NaCI, K2SO4 dan FeCl3
GARAM ASAM
Yaitu golongan garam yang masih mengandung ion H+ yang terikat pada ion sisa asam.
Contohnya:
NaHSO4 dengan nama natrium hydrogen sulfat, KH2PO4 : kalium dihidrogen fospat dan NaHCO3 dengan nama natrium hydrogen karbonat.
Garam asam dapat diahggap berasal dari asam yang mengandung lebih dan satu ion H, di mana dalam reaksi netralisasi ( reaksi asam dan basa ) pembentukan garam tidak semua ion H diganti oleh ion logam dan basa.
GARAM BASA
Yaitu golongan garam yang masih mengandung ion OH dan basa. Contohnya Ca(OH)Cl dengan nama calsium clorida basa dan Bi(OH)2N03 dengan nama Bismut nitrat dibasa. Garam basa dapat dianggap berasal dari basa yang mengandung lebih dari satu ion OH, dimana dalam reaksi netralisasi pembentukan garam tidak semua ion OH digantikan oleh ion sisa asam.
GARAM RANGKAP
Garam rangkap adalah golongan garam yang dalam bentuk kristalnya adalah gabungan dua jenis garam. Contoh tawas dengan rumus Na2SO4. Al2 ( SO4 ). 24 H20 adalah gabungan dan garam Na2SO4 dengan A12( SO4 ) yang membentuk kristal dengan mengikat 24 molekul air, Rumus tawas ini sering ditulis dalam rumus empiris I perbandingannya NaAI (S04)2.12 H20.
Sedangkan contoh garam rangkap yang lain adalah Karnalit / KCI MgCI2 6H20, Sconit : K2S04 MgSO4 6H20 dan garam Mohr: (NH4)2S04 FeSO4 6 H20.
GARAMKOMPLEK
Garam yang melibatkan unsur transisi / gd B
Contohnya : K4[Fe(CN)6] dengan nama kalium heksa siano ferat (II), K3[Fe(CN)6] dengan nama kalium heksa siano ferat (III) dan [Ag(NH3)2]Cl dengan nama diamin perak (I) clorida.
Pada garam ini ada yang merupakan ion sederhana dan ada yang disebut ion komplek, misalnya pada K.4[Fe(CN)6] terdiri dari K+ dan [Fe(CN)6)4-.